砷(As)是一种剧毒类金属元素,在水体或土壤污染有-3、0、+3和+5等四种价态,通常以含As(Ⅲ)和As(Ⅴ)的阴离子形式存在[1]
与氧化态 As(Ⅴ)相比,As在大多数土壤和水体中主要以还原态的As(Ⅲ)存在,同时As(Ⅲ)具有更高的水溶性和迁移性[2],其毒性远强于As(Ⅴ),具有持续时间长、不可生物降解等特性
As(Ⅲ)易于在人体累积,长期接触低浓度含As水体可导致慢性中毒,直接暴露在高浓度As环境下会导致人体机能紊乱、肾脏损害、白细胞减少等症状,甚至引发癌症,导致死亡[3]
近年来,由于磁性颗粒独特的金属离子吸附性能和易于分离的特性,磁性颗粒作为吸附剂材料处理环境污染问题受到了越来越多的关注[4]
利用磁性吸附材料与重金属之间发生特定的吸附、螯合和氧化还原作用,吸附并捕获土壤或溶液中的重金属离子,可以实现选择性地从工业废水或污染土壤中提取重金属离子[5]
GHOVEISI等[6]利用零价铁(ZVI)颗粒的络合能力及其强磁性特性,从处理土壤分离与ZVI形成配合物的重金属铜(Cu)和锌(Zn),修复后水可溶铜和锌的毒性降低了两个数量级
ZHOU等[7]用一种纳米
复合材料用于铬污染土壤的修复,通过磁分离可高效地将吸附铬离子的磁性材料从土壤中分离
铁以及铁化合物对As(Ⅲ)的亲和力高,且具有较高的反应活性,在高As水处理方面表现出色[8]
常用的铁基材料包括零价铁(ZVI)、铁氧化物(Fe3O4、Fe2O3)、羟基氧化铁(FeOOH)等[9]
事实上,硫化亚铁作为As(Ⅲ)的传统吸附材料,具有来源较广、价格便宜等优势,因此可以作为As的一种有效吸附材料
然而,当前的研究更多集中于对硫化亚铁的改性及纳米级制备,关于硫化亚铁对As(Ⅲ)的吸附机理仍无清晰的解释,同时也未见其在As污染土壤的磁分离修复方面的推广应用
本文通过硫化亚铁对模拟液中As的吸附试验、SEM-EDS、XRD谱、XPS分析以及Raman光谱分析等手段,系统研究了硫化亚铁对As(Ⅲ)的吸附性能及吸附机理
此外,以磁性硫化亚铁作为磁性颗粒,应用于As污染土壤的磁分离修复,通过磁选实现负载As的磁性硫化亚铁与土壤体系的分离,从而实现土壤修复的目的
探究了pH、液固比、磁性颗粒添加量对硫化亚铁修复As污染土壤的影响,确定了最佳修复条件,并在湖南某建设用地土壤上进行了扩大试验
1实验1.1磁性硫化亚铁的制备将分析纯的块状硫化亚铁用JC6型颚式
破碎机分两段破碎至2 mm以下,随后用行星式球磨机研磨10 min;使用200目和400目的标准筛对研磨后产物进行筛分,最终得到粒度范围为38~74 μm的硫化亚铁颗粒
采用无水乙醇洗涤并使用0.15T磁铁选出磁性能良好的硫化亚铁颗粒,经低温真空干燥后,使用真空袋密封保存以备后续试验使用[10]
图1所示为硫化亚铁的XRD谱和磁滞回线
X射线衍射分析结果(见图1(a))表明,硫化亚铁的晶型较为完整,在2θ角为30.0°、33.7°、43.2°和53.2°处,XRD谱线出现明显的硫化亚铁的特征衍射峰[11],同时可观察到少量FeO的特征峰存在,这主要是在水和空气的作用下硫化亚铁发生轻微氧化所致[12]
硫化亚铁的磁滞回线(见图1(b))表现出铁磁性物质特有的S型,硫化亚铁在磁场的作用下迅速被磁化达到饱和,其饱和磁化强度(Ms)为35 A?m2/kg,说明硫化亚铁具有较强的磁性,基本可以满足磁分离的要求,是一种较为理想的磁性吸附材料
图1硫化亚铁的XRD谱和磁滞回线
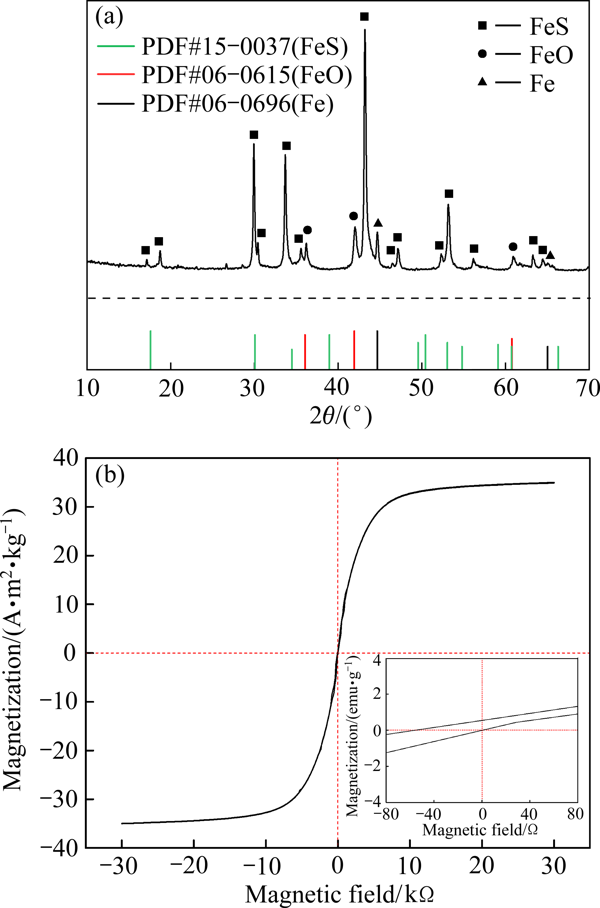
Fig. 1XRD pattern(a) and hysteresis loop(b) of ferrous sulfide1.2As(Ⅲ)污染水体修复试验1.2.1序批试验称取0.8670 g亚砷酸钠(NaAsO2)于烧杯中,加入少量去离子水溶解后转移至1 L容量瓶,定容、摇匀,配制成500 mg/L的As(Ⅲ)溶液,后续吸附条件试验所用模拟液均使用500 mg/L的As(Ⅲ)溶液经过稀释配制
分别量取50 mL一定浓度的As(Ⅲ)溶液并调节至测试pH,随后在其中加入一定质量的硫化亚铁,再放入25 ℃恒温水浴锅中以200 r/min的速度振荡反应一段时间
反应结束后用针管抽取5 mL上清液,经0.45 μm针孔滤膜过滤后,用ICP-OES测量溶液中剩余As含量
1.2.2吸附等温模型实验Langmuir等温吸附模型假设吸附剂表面的活性位点数有限,仅存在单层吸附,其数学表达式为:(1) 其线性方程为:(2) 式中:Qe为平衡时吸附质在吸附剂上的量(mg/g);ce为平衡时溶液中吸附质的量(mg/L);Qm为吸附剂的最大吸附量(mg/g);Kl为Langmuir吸附常数(L/mg)[13]
Freundlich 等温吸附模型是较为常用的描述吸附平衡的模型之一,其数学表达式为:(3) 其线性方程为:(4) 式中:吸附特征常数Kf和n分别表示吸附能力和吸附强度
1.2.3吸附动力学试验准一级动力学模型假定吸附过程受扩散过程控制,描述的是通过边界分子扩散方式控制的吸附进程,其一级速率方程如下所示:(5) 式中:t为反应时间(min);Qt表示时间为t时的吸附量(mg/g);k1为准一级吸附速率常数(min-1)
准二级动力学模型是假定吸附速率受化学吸附机理调控,认为其存在电子的转移及公用,准二级速率方程如下所示:(6) 式中:k2表示准二级吸附速率常数(g·mg-1·min-1)
1.3供试土壤试验土壤取自湖南省株洲市某建筑用地(实验室试验与半工业试验相同),该建筑用地靠近某硫铁矿制酸企业
在硫铁矿制酸工艺过程中,硫铁矿中伴生的As进到废气、废水和废渣中,从而通过大气沉降、废水跑冒滴漏、废渣遗撒等途径造成土壤和地下水污染
经测试发现,该地土壤As含量严重超标,As含量为92 mg/kg
将上述土壤样品剔除大块石块和少量植物根系后,在≤50 ℃下烘干后破碎,用100目的标准筛筛分,筛下土壤用于后续试验
试验所用农田土壤pH值为5.5,属弱酸性土壤,主要化学元素分析结果如表1所示
表1农田土壤化学元素分析Table 1Chemical element analysis of farmland soil (mass fraction, %)OSiAlFeK47.2230.2411.023.721.47TiMgCaSP0.650.310.300.110.071.4As污染土壤磁分离修复试验污染土壤实验室磁分离修复流程如图2所示,取5.0 g土壤样品按照一定的液固比加入去离子水,使用盐酸或氢氧化钠溶液调节pH值,搅拌均匀后加入定量磁性硫化亚铁,在25 ℃的恒温振荡水浴锅中以200 r/min的速度振荡24 h
反应结束后通过磁棒将吸附有重金属的磁性硫化亚铁吸出,土壤样品经过滤烘干后进行消解测试As含量[14]
图2污染土壤磁分离修复试验流程

Fig. 2Flowsheet of magnetic remediation of contaminated soil1.5分析表征实验在300 mL的As(Ⅲ) (50 mg/L)溶液中加入0.5 g硫化亚铁颗粒,调节溶液pH值为6.0~8.0;然后将溶液放入25 ℃恒温水浴锅中振荡24 h,再用磁铁吸出磁性颗粒并放入布氏漏斗中;最后将过滤洗涤后的磁性颗粒放入真空干燥箱中烘干保存,即为与As(Ⅲ)反应后的硫化亚铁
采用扫描电子显微镜(SEM,JSM-6380LV,JEOL Ltd.)对与As(Ⅲ)反应前后的硫化亚铁的形貌和结构进行表征,工作电压为5.0 kV;利用能谱仪(EDS,Bruker XFlash 5010,Germany)对反应前后的硫化亚铁中的元素进行分析
利用X射线衍射分析(XRD)对反应前后的硫化亚铁进行物相
分析检测
具体测量参数如下:步长范围为5°~80°;步长为0.010°;停留时间为28.8 s;发射源为Al Kα2
利用X射线电子能谱(XPS,Thermo Scientific: Esala 250Xi) 对样品表面Fe、O、As进行元素价态分析,确定它们的结合态
测试时采用Al Kα作为发射源,光电子以1486.6 eV能量打到固体表面,使样品表面的原子的内层电子或价电子受激发而发射出来
通过测量光电子的能量和相对强度绘制光电子能谱
样品中所有元素的结合能通过外源碳C1s=284.8 eV进行校正
使用Thermoavantage软件进行分峰拟合
采用傅里叶红外光谱仪测试反应前后硫化亚铁表面官能团的变化
测试时取少量样品和溴化钾混匀,压片完成后将得到的薄片放置在红外光谱仪中进行测量
使用显微拉曼光谱仪(inVia)对反应前后的硫化亚铁进行分析:取大约0.1 g待测样品直接放置在玻璃上并轻轻按压至表面平整,使用显微镜观察并选定测试区域后使用激光照射样品表面,入射光子与分子之间发生非弹性碰撞后,产生拉曼散射
2结果与讨论2.1模拟As污染水体净化试验研究2.1.1吸附特征与吸附等温线拟合图3所示为不同pH条件下As(Ⅲ)的去除效果以及存在状态
从图3中可以看出,硫化亚铁对As的去除率在pH<9时保持在较高的水平;随着从pH值从9增加至11,硫化亚铁对As(Ⅲ)的去除率由98%降低至10%左右
这主要与不同pH条件下H3AsO3的不同组分有关[15]
随着pH的升高,溶液中As(Ⅲ)的主要组分由H3AsO3转变为(见图3(b)),影响了硫化亚铁对As(Ⅲ)的吸附
图3不同pH条件下As(Ⅲ)的去除效果以及存在状态

Fig. 3Effects of pH on As(Ⅲ) removal(a) and fractions(b)在初始浓度为10 mg/L的As(Ⅲ)模拟液中,硫化亚铁对As(Ⅲ)的去除率为99.35%
随着溶液中初始As(Ⅲ)浓度的上升,去除率略微下降至98.77%
这是因为在硫化亚铁的用量一定的条件下,当溶液中As(Ⅲ)含量增加时,硫化亚铁颗粒表面剩余的吸附位点逐渐减少,导致其对As(Ⅲ)的去除率有所下降
图4所示为初始As(Ⅲ)浓度对硫化亚铁去除As(Ⅲ)的影响
从图4中可以看出,硫化亚铁对As(Ⅲ)的吸附量却会随着As(Ⅲ)浓度升高而增加,由4.97 mg/g (10 mg/L As(Ⅲ))增加至49.39 mg/g(100 mg/L As(Ⅲ)),这主要是因为随着As(Ⅲ)浓度的增加,浓度梯度的驱动力逐渐增加,克服了固液界面的传质阻力[16]
图4初始As(Ⅲ)浓度对硫化亚铁去除As(Ⅲ)的影响
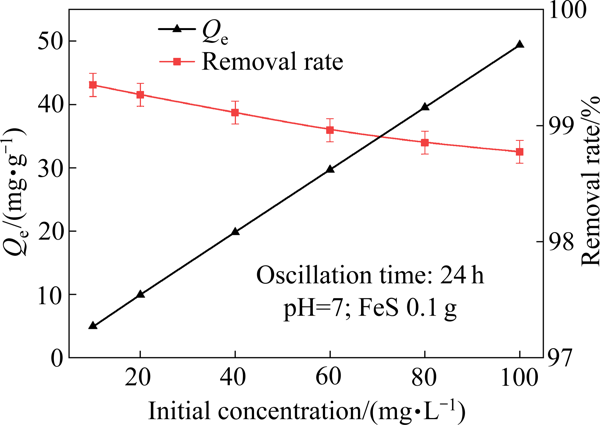
Fig. 4Effect of initial As(Ⅲ) concentration on As(Ⅲ) removal by ferrous sulfide为了进一步分析磁性硫化亚铁对As(Ⅲ)的吸附行为,探究其吸附机理,采用Langmuir和Freundlich模型对试验数据进行拟合,拟合分析结果如图5和表2所示
由图5和表2可以看出,硫化亚铁对As(Ⅲ)的吸附行为均与两个吸附模型拟合得较好,且Freundlich模型(R2=0.9989)的拟合效果要优于Langmuir模型(R2=0.9469),表明As(Ⅲ)在FeS表面发生了不均匀的多层吸附
通过Langmuir吸附模型计算,磁性硫化亚铁对As(Ⅲ)的饱和吸附量可达100 mg/g,吸附性能良好
图5硫化亚铁吸附As(Ⅲ)的Langmuir和Freundlich等温吸附模型的线性拟合结果

Fig. 5Linear fitting results of Langmuir(a) and Freundlich(b) isotherm adsorption models for As(Ⅲ) adsorption by ferrous sulfide表2硫化亚铁吸附As(Ⅲ)的Langmuir和Freundlich等温吸附模型的参数Table 2Parameters of Langmuir and Freundlich isotherm adsorption models for As(Ⅲ) adsorption by ferrous sulfideModelParameterR2LangmuirKl/(L?mg-1)Qm/(mg?g-1)0.94690.714100.000FreundlichnKf/(mg?g-1)0.99891.28942.8202.1.2吸附时间与吸附动力学曲线拟合图6所示为反应时间对硫化亚铁去除模拟液中As(Ⅲ)的影响
由图6可见,在0~120 min之间硫化亚铁对As(Ⅲ)的去除率迅速升高,由0增加至41.7%,属于快速吸附阶段;随着反应时间从120 min增加至720 min,去除率的增加速率开始放缓,说明硫化亚铁表面大量空余活性位点已被占据,而溶液中As(Ⅲ)向固体表面扩散的趋势逐渐趋于饱和,固液传质阻力的增强使得去除率升高缓慢并趋于稳定,属于慢速吸附阶段[17]
而当吸附时间达到1440 min后,As(Ⅲ)的去除率稳定在72%左右
因此,在保证硫化亚铁对As高效去除的基础上,反应时间设定为1440 min
图6反应时间对硫化亚铁去除模拟液中As(Ⅲ)的影响

Fig. 6Effect of reaction time on As(Ⅲ) removal from simulated solution by ferrous sulfide为进一步探究硫化亚铁对模拟液中As(Ⅲ)吸附行为随时间的变化特征,采用准一级和二级动力学模型对试验数据进行拟合,拟合结果如图7所示
由图7可以看出,硫化亚铁对As(Ⅲ)的吸附行为更适用于准二级动力学模型(R2=0.9991),表明硫化亚铁对As(Ⅲ)的吸附是以化学吸附为主
吸附过程中的其他动力学参数如表3所示
由表3可见,准二级动力学模型拟合所得平衡吸附量Q2=24.390 mg/g,与试验结果基本吻合,这也进一步验证了准二级动力学模型更适用于硫化亚铁对As(Ⅲ)吸附数据的拟合
图7硫化亚铁吸附As(Ⅲ)的准一级和准二级动力学模型线性拟合结果
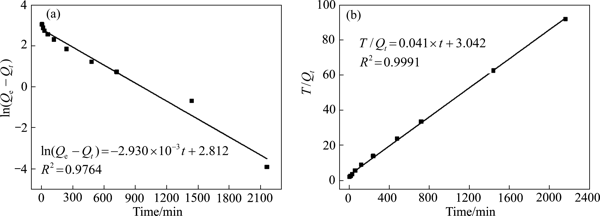
Fig. 7Linear fitting results of pseudo-first order(a) and pseudo-second order(b) kinetic models for As(Ⅲ) adsorption by ferrous sulfide表3硫化亚铁吸附As(Ⅲ)的动力学参数Table 3Kinetic parameters of As(Ⅲ) adsorption by ferrous sulfideModelParameterR2Pseudo-first-order kineticsQ1/(mg?g-1)K10.976416.6432.930×10-3Pseudo-second-order kineticsQ2/(mg?g-1)K20.999124.3905.526×10-42.2硫化亚铁对As(Ⅲ)的去除机理研究2.2.1硫化亚铁表面吸附As(Ⅲ)前后的SEM-EDS分析图8所示为制备的磁性硫化亚铁颗粒的SEM和EDS分析结果
从图8(a)和(b)中可以看出,磁性硫化亚铁颗粒主要呈现不规则的块状结构,表面较为平整,存在少许褶皱,这主要是加工过程中硫化亚铁颗粒表面断裂和解离造成的
能谱分析结果表明,硫化亚铁颗粒表面主要元素为Fe、S和O
吸附As(Ⅲ)后硫化亚铁表面明显覆盖了一层由不规则颗粒组成的壳状物,且表面经干燥脱水后出现了很多细小的裂纹和集簇(见图8(c)和(d)),这可能是含As化合物在硫化亚铁表面富集造成的
采用能谱仪对反应后硫化亚铁颗粒表面区域进行分析发现,其主要成分为Fe、O、As和S,各成分含量分别为44.05%、28.89%、18.10%和8.96%
其中Fe仍是硫化亚铁表面含量最高的元素,但由初始的75.35%下降至44.05%;同时观察到O含量由5.29%上升到28.89%,表明吸附过程中存在一定的氧化作用
As在磁性硫化亚铁表面的大量富集(18.1%),进一步证实了硫化亚铁对As具有较好的吸附效果
图8硫化亚铁吸附As(Ⅲ)前后的SEM像和EDS分析结果

Fig. 8SEM images and EDS analysis results of ferrous sulfide before((a), (b), (e)) and after((c), (d), (f)) As(Ⅲ) adsorption2.2.2吸附As(Ⅲ)前后硫化亚铁表面的XRD分析图9所示为吸附As(Ⅲ)前后硫化亚铁的XRD谱
由图9可以看出,吸附As(Ⅲ)后硫化亚铁表面的硫化亚铁、氧化亚铁和铁的衍射峰仍然存在,其位置未发生明显改变,但强度明显减弱,一些硫化亚铁的衍射峰甚至消失
这可能是由于As(Ⅲ)与表面硫化亚铁发生作用,导致硫化亚铁表面晶体结构遭到破坏
硫化亚铁表面存在的杂质Fe衍射峰并没有减弱,这可能是因为铁单质在除As过程中作用效果并不明显
同时,从XRD谱中并未发现含As化合物的存在,这是由于反应结晶时间不足,使得含As化合物结晶较差[18]
同时,硫化亚铁表面生成的无定型含As化合物也会在一定程度上遮蔽硫化亚铁晶体,造成硫化亚铁晶体衍射峰值较小
图9吸附As(Ⅲ)前后硫化亚铁的XRD谱

Fig. 9XRD patterns of ferrous sulfide before and after As(Ⅲ) adsorption2.2.3吸附As(Ⅲ)前后硫化亚铁表面的XPS分析采用XPS对硫化亚铁与As(Ⅲ)之间的作用机理进一步分析
图10所示为吸附As(Ⅲ)前后硫化亚铁表面XPS分析
从图10可以看出,在反应前后硫化亚铁的XPS全谱上,反应后硫化亚铁表面出现了As 3d和As 2p的特征峰,表明As(Ⅲ)在硫化亚铁上得以有效的吸附固定
图10吸附As(Ⅲ)前后硫化亚铁表面XPS分析
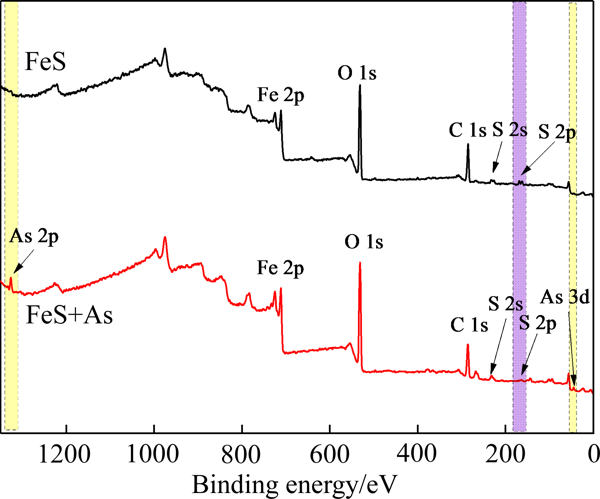
Fig. 10XPS spectra of ferrous sulfide before and after As(Ⅲ) adsorption为了进一步分析硫化亚铁对As的去除过程,分别对S 2p、O 1s、Fe 2p和As 3d的精细谱进行测试及分峰拟合分析,试验结果如图11所示
从硫化亚铁吸附As(Ⅲ)前后的S 2p图谱(见图11(a))可以看出,初始硫化亚铁表面的S,主要由结合能位置在161.4 eV处的S2-、162.6 eV处的、166.9 eV的和(168.4和169.7 eV)组成[15, 19],其表面丰富的硫化物可能与硫化亚铁表面在制备和储存过程中发生了一定的氧化有关
与As(Ⅲ)反应后,硫化亚铁表面的S含量明显减少,虽然在结合能160~171 eV的范围内仍有部分凸起,但无明显的峰形结构,表明硫化亚铁表面的S趋于多样化但含量降低
查阅文献可知[19],硫化亚铁可以与H3AsO3及发生如式(7)~(9)的反应:(7)3FeS+H3AsO3=FeAsS+Fe(OH)3+FeS2 (8)3FeS+2H3AsO3+8H+=As2S3+3Fe2++6H2O(9)2FeS++H2O=+2Fe(OH)2 图11吸附As(Ⅲ)前后硫化亚铁的S 2p、O 1s、As 3d和Fe 2p谱
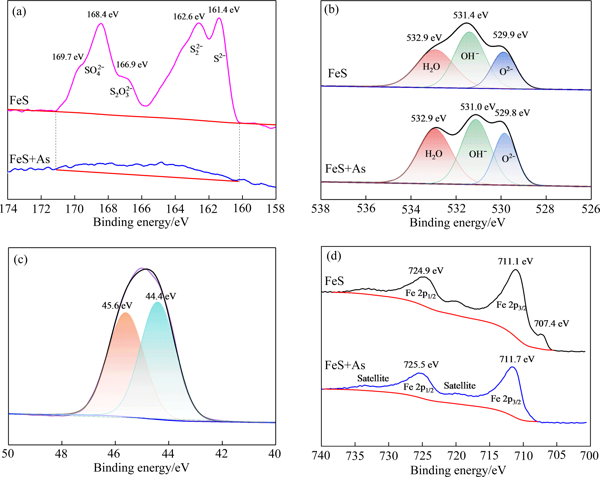
Fig. 11Spectra of ferrous sulfide before and after As(Ⅲ) adsorption: (a) S 2p; (b) O 1s; (c) As 3d; (d) Fe 2pFeAsS、As2S3和FeS2的生成进一步促进了硫化亚铁表面硫化学状态的多样化
例如,当式(9)反应生成可溶的迁移至溶液时,会导致硫化亚铁表面S含量的降低
这也解释了3.1.1节中为什么pH>9时,硫化亚铁对As(Ⅲ)的去除效果变差:当pH>9时,溶液中的主要组分为,发生式(9)所示的反应后生成的进入溶液,无法有效固定在硫化亚铁表面,导致As(Ⅲ)去除效果变差
同时,在水溶液中有溶解氧存在的情况下,硫化亚铁表面FeS和FeS2的Fe—S键易发生断裂[20],在水和氧气的共同作用下进一步溶解,形成可溶性的硫酸盐进入到溶液中[15, 21],这同样造成了硫化亚铁表面S含量的降低
从硫化亚铁吸附As(Ⅲ)前后的O 1s谱(见图 11(b))可以看出,初始硫化亚铁表面的氧分为三个峰,主要是由结合能在529.9 eV处Fe—O所代表的晶格氧、结合能在531.4 eV处的—OH和结合能在532.9 eV处的吸附水组成[22]
硫化亚铁在含有溶解氧的水溶液中会发生反应,生成氢氧化铁及羟基氧化铁,如式(10)和(11)所示:(10) (11)Fe(OH)3=FeOOH+H2O硫化亚铁的氧化-羟基化产物FeOOH在吸附过程中会与H3AsO3发生配位离子交换,生成As—O—Fe键,同时转变为氧化铁[23],造成Fe—OH含量比例从41.7%降低至38.3%,而Fe—O峰含量比例由初始的21.6%增加至23.2%,且新峰的位置由529.9 eV向低结合能处偏移0.1 eV
同时,观察比较发现硫化亚铁表面的Fe—OH峰发生了较大的偏移,从531.4 eV降低至531.0 eV,表明As(Ⅲ)在硫化亚铁表面的铁氧化物及铁氢氧化物发生了吸附,吸附位点上的OH-进行配体交换,在表面形成以双齿双核为主的内球配合物[24],得电子能力弱的As(Ⅲ)在其表面的化学吸附作用,导致对应于Fe—OH的O1s结合能降低[17-18]
硫化亚铁对As的去除是一个复杂的过程,包括表面共沉淀和吸附过程[15]
从As 3d高分辨率光谱图的分峰拟合结果(见图11(c))可以看出,吸附在硫化亚铁表面的As可以分为二个峰,其中在结合能为45.6 eV和44.4 eV处的峰分别表示As(Ⅴ)和As(Ⅲ)[25],两者的面积比约为1∶1,As(Ⅲ)的含量要略多于As(Ⅴ)
值得注意的是,由于反应前溶液中为As(Ⅲ),而经硫化亚铁吸附后,约有47%的As(Ⅴ)出现在硫化亚铁表面,说明硫化亚铁吸附As(Ⅲ)过程存在部分As(Ⅲ)被氧化为As(Ⅴ)
这可能是其中一部分As(Ⅲ)被溶液中的溶解氧氧化成As(Ⅴ)所致[26],还有一部分As(Ⅴ)可能是As(Ⅲ)与硫化亚铁表面形成配合物后再被被氧化所致[27-28]
从反应前硫化亚铁的Fe 2p精细图谱(见图11(d))可以看出,在结合能为707.4 eV处的峰归因于FeS2的峰[19, 29],这可能是硫化亚铁在制备过程中存在部分FeS转化为FeS2的情况发生[30]
吸附As(Ⅲ)后的硫化亚铁表面并未发现该峰的存在,这是由于吸附反应过程中FeS2的S可被As(Ⅲ)和As(Ⅴ)取代,通过配位离子交换实现对As的吸附,反应如式(12)、(13)所示[31]:(12)Fe—S+→Fe—AsO3H+HS- (13)Fe—S+→Fe—AsO4H+HS- 在结合能为724.9 eV和711.1 eV处分别由Fe的自旋轨道双峰Fe 2p1/2和Fe 2p3/2组成,同时观察到Fe的卫星峰存在,表明硫化亚铁表面同时含有三价和二价铁离子[32]
结合XRD分析结果(见图9)可知,硫化亚铁表面除含有FeS外,还包含少量的Fe、FeO和FeS2和无定型FeOOH
当硫化亚铁吸附As(Ⅲ)后,Fe 2p1/2和Fe 2p3/2 的结合能增加至725.5 eV和711.7 eV,结合能均向高能位置偏移了0.6 eV,表明As(Ⅲ)的吸附促进了Fe 2p向高能位置移动,同时也表明吸附过程中存在部分二价铁向三价铁转换,并主要以无定型的FeOOH形式存在于硫化亚铁表面[33-34]
2.2.4吸附As(Ⅲ)前后硫化亚铁表面的拉曼光谱分析由于As—O的伸缩振动对环境的灵敏度较高,因此可通过拉曼光谱(Raman)确定As吸附前后硫化亚铁表面As的附存状态
图12所示为吸附As(Ⅲ)前后硫化亚铁的拉曼光谱
从图12中可以看出,初始硫化亚铁表面在209和282 cm-1处有两处强而清晰的拉曼峰,表示FeS两个的特征峰[35]
当硫化亚铁吸附As(Ⅲ)之后,在波数为811和838 cm-1处发现了两处较强的拉曼峰[36-37],这归因于As在颗粒表面发生了较强的化学吸附作用
尽管As(Ⅲ)的振动频率低于As(Ⅴ),但其在铁基矿物表面吸附峰的位置非常相似[36]
结合XPS分析结果,可以说明As(Ⅲ)和As(Ⅴ)均较好的吸附在硫化亚铁表面
而吸附后的硫化亚铁表面无定型的FeOOH峰(385 cm-1)和FeS的特征峰(209和282 cm-1)消失,同样可以说明As通过和FeS反应生成沉淀物覆盖在硫化亚铁,另一部分As和硫化亚铁表面FeOOH发生了双配位键合,与XPS分析结果一致
图12吸附As(Ⅲ)前后硫化亚铁的拉曼光谱
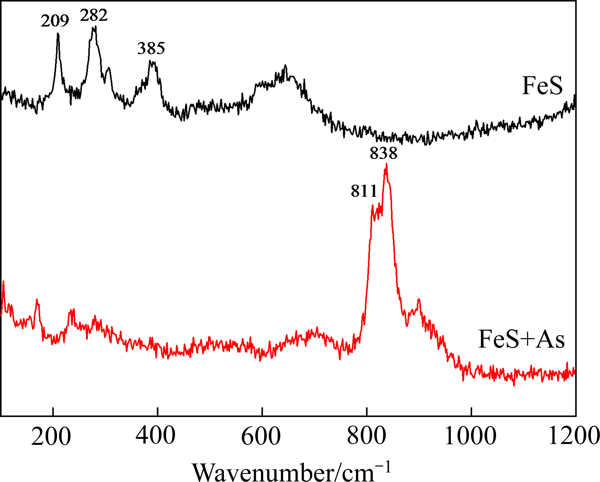
Fig. 12Raman spectra of ferrous sulfide before and after As(Ⅲ) adsorption2.2.5吸附-去除机理小结FeS的吸附过程涉及多次氧化还原反应和多种吸附形态,其反应过程受到氧含量条件、pH值等多因素的影响,在常见的有溶解氧参与的弱碱性/中性As污染水体中,如图13所示
As(Ⅲ)的去除机理总结归纳起来可分为以下三种途径
图13硫化亚铁吸附As(Ⅲ)的机理示意图
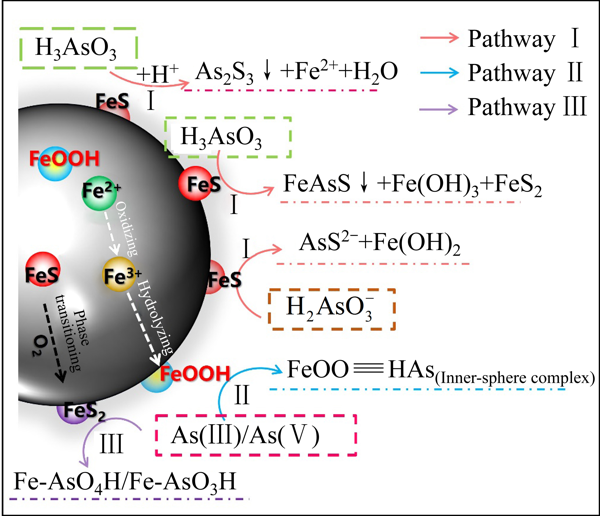
Fig. 13Schematic diagram of adsorption mechanism of As(Ⅲ) on ferrous sulfide途径Ⅰ:H3AsO3/与FeS发生反应,生成As2S3和FeAsS沉淀物吸附在硫化亚铁颗粒,从而实现磁分离去除
值得注意的是,当碱性过高即pH值大于9时,As(Ⅲ)主要以形式存在,此时的反应产物以可溶性的AsS2-为主,无法生成沉淀有效沉积在硫化亚铁表面,因此As(Ⅲ)去除效率较低
途径Ⅱ:在常规污染水体中溶解氧存在的条件下,硫化亚铁表面溶出的Fe2+会经氧化-水解系列反应,生成具有高吸附活性的无定形FeOOH,As(Ⅲ)以及氧化生成的As(Ⅴ),均可以与其吸附位点上的OH-进行配体交换,在表面形成以双齿双核为主的内球络合物,最终通过磁选脱离水体
途径Ⅲ:XRD谱以及拉曼光谱分析中均可见FeS2的特征峰,这是由于FeS在溶解氧存在的条件下产生的相变,在马基诺矿与黄铁矿的相变研究中已见报道[38]
FeS2晶体结构中Fe的位置存在部分缺失[39],故而具有更多的吸附位点吸附As离子;更重要的是,FeS2的 S更容易被As取代,通过配位离子交换实现其对As(Ⅲ)及As(Ⅴ)的吸附
2.3As污染土壤净化试验研究2.3.1试验条件对As污染土壤修复的影响图14所示为液固比、硫化亚铁用量以及土壤pH对As污染土壤修复的影响
由图14(a)可见,加入磁性硫化亚铁进行磁分离修复后,土壤中的As含量有了较为明显的下降;随着土壤体系液固比的增加,修复后土壤中的As含量从87 mg/kg逐渐下降至66 mg/kg,表明随着土壤中含水量的增加,硫化亚铁在土壤溶液体系中分布更加均匀,更易与体系中的As发生作用
在液固比达到3以后,土壤的修复效果并不会进一步提高,说明通过持续增加液固比无法达到最终的修复效果
同时,随着反应体系中液固比的增加,磁分离过程夹带的土壤质量也逐渐减小,并在液固比为3后达到稳定,最低夹带量为0.1 g
图14液固比、硫化亚铁用量以及土壤pH对As污染土壤修复的影响

Fig. 14Effect of liquid-solid ratio(a) ferrous sulfide dosage(b) and soil pH(c) on remediation of As contaminated soil由图14(b)可见,随着磁性硫化亚铁用量的增加,修复后土壤中As含量逐步下降,并在用量为2%时开始趋于稳定;此时土壤中的As含量为68 mg/kg,硫化亚铁对土壤中As的去除率为26%,表明硫化亚铁实现了对土壤中部分As的有效吸附
由图14(c)可见,当土壤pH值为3~6时,As的去除效果基本维持不变,修复后土壤的As含量为59 mg/kg,修复效果较好
因此,后续扩大实验不调pH,在酸性土壤的初始pH=5.5下进行试验
随着土壤pH的升高,磁性硫化亚铁对土壤中的As去除效果逐渐减弱,在土壤pH=9时,修复后土壤的As含量仍有83 mg/kg,远高于酸性条件
这表明碱性环境对磁性硫化亚铁吸附土壤中的As有抑制作用,与水体中As去除试验以及机理分析结果一致
文献表明在酸性条件下土壤胶体呈现正电性,易与带负电荷的结合,使其在土壤中的水溶性和交换态活性降低[40-42]
但是试验中磁性硫化亚铁在低pH条件下对As的吸附效果却较好,说明影响硫化亚铁修复的主要因素并不是As在土壤中的活性,而是硫化亚铁与As之间的作用
2.3.2半工业试验研究在As污染土壤修复实验室试验的基础上,进行了As污染土壤磁分离修复的半工业试验,其设计及流程如图15所示
半工业试验包含以下步骤:灌水的同时使用旋耕机(刀片规格225 mm、245 mm或265 mm)将灌溉后的土壤打碎,使土壤呈泥浆状
随后,在旋耕机搅拌的同时将泥浆泵送至反应搅拌桶,调节泥浆的液固比为3∶1、pH=6后,按照质量比例施加磁性硫化亚铁吸附材料;在反应桶不断搅拌泥浆,使硫化亚铁吸附材料与土壤充分接触,吸附反应24 h
待反应结束后将含有硫化亚铁的泥浆泵送至滚筒磁选机(0.5 T),将土壤中的磁性硫化亚铁进行充分回收,保证磁性硫化亚铁的回收率在95%以上
使用混凝土桩将试验用地分割为4块大小均一的试验地,在4块试验地中分别施加不同质量的磁性硫化亚铁进行试验
图15磁分离修复As污染土壤的半工业试验流程布置图

Fig. 15Layout drawings of semi-industrial experiment flow for magnetic remediation of As contaminated soil图16所示为磁分离修复As污染土壤半工业试验结果
从图16可以看出,场地修复实验中一次修复不足以将As污染土壤中的As含量降至 60 mg/kg以下(以《土壤环境质量建设用地土壤污染风险管控标准》(GB 36600—2018)中规定的As的第二类用地的筛选值(60 mg/kg)作为评价标准)
单次场地修复的As去除率低于实验室试验的As去除率,这可能是实际场地修复中硫化亚铁吸附材料与土壤接触不够充分所致
因此,场地修复试验每一组按照相同的试验条件,进行了三次的重复修复,每次修复后测土壤的As含量
当硫化亚铁用量为0.5%时,修复效果较差,As去除率不足22%
随着硫化亚铁用量的增加,修复后土壤As含量逐步降低;当硫化亚铁的用量大于2%时,经三次修复后土壤As含量低于60 mg/kg
这表明硫化亚铁吸附-磁分离的方法可以在扩大实验中修复As污染土壤,取得了良好的修复效果
图16磁分离修复As污染土壤半工业试验结果
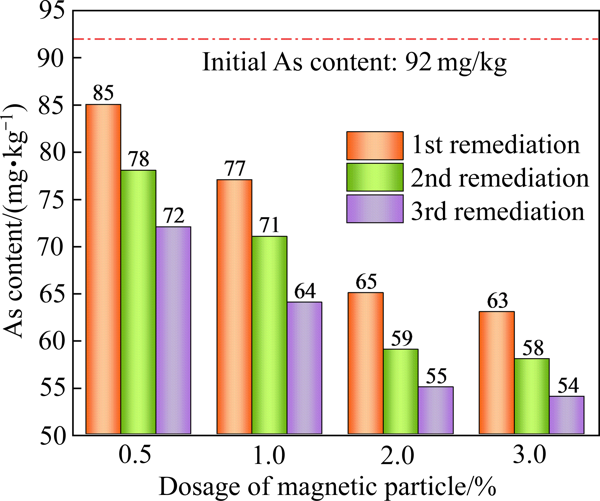
Fig. 16Semi-industrial experiment results of magnetic remediation of As contaminated soil3结论1) As(Ⅲ)溶液的单因素探究试验表明,硫化亚铁对As的去除效果在较宽的pH范围内(pH值为3~9)均维持在较高的水平
且随着As(Ⅲ)初始浓度的升高,硫化亚铁对As的吸附量也明显增加
硫化亚铁吸附As(Ⅲ)更适用于Freundlich模型,说明硫化亚铁表面存在多层不均一的吸附关系
2) 在浓度范围为0~100 mg/L的As(Ⅲ)模拟液中,硫化亚铁的最大饱和吸附量为100 mg/g,达到饱和吸附量的时间为1440 min左右
硫化亚铁对As(Ⅲ)的吸附行为更适合准二级动力学模型,说明硫化亚铁对As的吸附行为以化学吸附为主
3) 结合硫化亚铁吸附As(Ⅲ)前后的SEM成像和EDS结果、XRD谱、XPS分析结果以及Raman光谱分析,可以得出硫化亚铁对水溶液中As(Ⅲ)的去除主要包括三种途径:①H3AsO3/与FeS发生反应,生成As2S3和FeAsS沉淀物吸附在硫化亚铁颗粒;②As(Ⅲ)以及氧化生成的As(Ⅴ),与高活性的无定形FeOOH吸附位点上的OH-进行配体交换,在表面形成以双齿双核为主的内球配合物;③FeS2晶体吸附As离子,以及通过FeS2中S与As的取代实现对As(Ⅲ)及As(Ⅴ)的吸附
4) 在水介质条件下进行磁性硫化亚铁修复含As土壤的实验室试验,结果表明,在液固比为3∶1、磁性颗粒添加量为土壤质量分数的2%、pH值为3~6的条件下,硫化亚铁吸附-磁分离的方法对As污染土壤的修复效果最好
5) 在优选最优试验条件下进行了扩大试验,修复后土壤中As含量由92 mg/kg下降至54 mg/kg,低于GB 36600—2018中规定的As的第二类用地的筛选值(60 mg/kg),实现了对As污染土壤的初步修复,为磁分离应用于土壤修复领域提供了借鉴
参考文献
张荥斐, 袁 佳, 田 佳, 等. 新生态FeS的缓释效应及其在铜砷硫化分离中的应用研究[J
中国
有色金属学报, 2022, 32(8): 2354-2364.ZHANG Xing-fei, YUAN Jia, TIAN Jia, et al. Sustained-release effect of armphous FeS and its application in sulfurization separation of copper and arsenic[J
The Chinese Journal of Nonferrous Metals, 2022, 32(8): 2354-2364.王 侠, 王 欣, 杜艳艳, 等. 改性纳米零价铁对稻田土壤As污染的修复效能[J
环境科学研究, 2017, 30(9): 1406-1414.WANG Xia, WANG Xin, DU Yan-yan, et al. Remediation efficiency of arsenic-contaminated paddy soil with modified nano-zero-valent iron[J
Research of Environmental Sciences, 2017, 30(9): 1406-1414.李 伟, 李 冰. 环境砷暴露对机体损伤的研究进展[J
环境与健康杂志, 2016, 33(9): 836-841.LI Wei, LI Bing. Health effects of long-time arsenic exposure: A review of recent studies[J
Journal of Environment and Health, 2016, 33(09): 836-841.FENG N, GHOVEISI H, BITTON G, et al. Removal of phyto-accessible copper from contaminated soils using zero valent iron amendment and magnetic separation methods: Assessment of residual toxicity using plant and MetPLATE? studies[J
Environmental Pollution, 2016, 219: 9-18.程红丹. 新型铁基功能复合材料的制备及土壤Pb污染修复研究[D
开封: 河南大学, 2018: 24-36.CHENG Hong-dan. Preparation of new iron-based function composites and remediation of soil plumnum pollution[D
Kaifeng: Henan University, 2018: 24-36.GHOVEISI H, FENG N, BOULARBAH A, et al. Effect of aging and wet-dry cycles on the elimination of the bioavailable fractions of Cu and Zn in contaminated soils by zero valent iron and magnetic separation technique[J
Journal of Environmental Engineering, 2018,144(8): 04018068.ZHOU Ling-lin, ZHANG Gui-long, WANG Min, et al. Efficient removal of hexavalent chromium from water and soil using magnetic ceramsite coated by functionalized nano carbon spheres[J
Chemical Engineering Journal, 2018, 334: 400-409.GONG Yan-yan, ZHAO Dong-ye, WANG Qi-lin. An overview of field-scale studies on remediation of soil contaminated with heavy metals and metalloids: Technical progress over the last decade[J
Water Research, 2018, 147: 440-460.张华夏. 稳定化纳米硫化亚铁粒子对水中砷的吸附性能及机理研究[D
广州: 华南理工大学, 2019: 22-35.ZHANG Hua-xia. Study on adsorption properties and mechanism of stabilized ferrous sulfide nanoparticles for arsenic in water[D
Guangzhou: South China University of Technology, 2019: 22-35.BERLICH A G, NESBITT H W, BANCROFT G M, et al. Binding of oxygen on vacuum fractured pyrite surfaces: Reactivity of iron and sulfur surface sites[J
Surface Science, 2013, 611: 60-66.LENNIE A R, REDFERN S A, CHAMPNESS P E, et al. Transformation of mackinawite to greigite: An in situ X-ray powder diffraction and transmission electron microscope study[J
American Mineralogist, 1997, 82(3/4): 302-309.SINGER P C, STUMM W. Acidic mine drainage: The rate-determining step[J
Science, 1970, 167(3921): 1121-1123.孟成奇. Fe-Al双金属介孔材料的制备及其处理水中三价砷的研究[D
长沙: 湖南农业大学, 2017.MENG Cheng-Qi. The preparation of Fe-Al bimetallic mesoporous composites and the research on its removal of As(Ⅲ) in aqueous solution[D
Changsha: Hunan Agricultural University, 2017.高 欣. 氨基酸盐对镉污染土壤淋洗效果的研究[D
无锡: 江南大学, 2020: 32-35.GAO Xin. Study on leaching effect of amino acid salts on cadmium-contaminated soil[D
Wuxi: Jiangnan University, 2020: 32-35.WU Du-li, PENG Shu-han, YAN Kai-li, et al. Enhanced As(Ⅲ) sequestration using sulfide-modified nano-scale zero-valent iron with a characteristic core-shell structure: Sulfidation and As distribution[J
ACS Sustainable Chemistry & Engineering, 2018,6(3): 3039-3048.WANG Yu-feng, TIAN Jia, PENG Jian, et al. Fundamental research on selective arsenic removal from high-salinity alkaline wastewater[J
Chemosphere, 2022, 307: 135992.BAKSHI S, BANIK C, RATHKE S J, et al. Arsenic sorption on zero-valent iron-biochar complexes[J
Water Research, 2018, 137: 153-163.JEONG H Y, HAN Y S, HAYES K F. X-ray absorption and X-ray photoelectron spectroscopic study of arsenic mobilization during mackinawite (FeS) oxidation[J
Environmental Science & Technology, 2010, 44(3): 955-961.BOSTICK B C, FENDORF S. Arsenite sorption on troilite (FeS) and pyrite (FeS2)[J
Geochimica et Cosmochimica Acta, 2003, 67(5): 909-921.MULLET M, BOURSIQUOT S, ABDELMOULA M, et al. Surface chemistry and structural properties of mackinawite prepared by reaction of sulfide ions with metallic iron[J
Geochimica et Cosmochimica Acta, 2002, 66(5): 829-836.FANTAUZZI M, LICHERI C, ATZEI D, et al. Arsenopyrite and pyrite bioleaching: evidence from XPS, XRD and ICP techniques[J
Analytical and Bioanalytical Chemistry, 2011, 401(7): 2237-2248.ZHANG B, CHEN N, FENG C P, et al. Adsorption for phosphate by crosslinked/non-crosslinked-chitosan-Fe(Ⅲ) complex sorbents: Characteristic and mechanism[J
Chemical Engineering Journal, 2018, 353: 361-372.关梦莎, 罗黎煜, 沈思文, 等. 天然磁黄铁矿吸附水中As(Ⅲ)的性能及机理[J
环境工程, 2021, 39(2): 33-40.GUAN Meng-sha, LUO Li-yu, SHEN Si-wen, et al. Adsorption performance and mechanism of natural pyrrhotite for As(Ⅲ) in water[J
Environmental Engineering, 2021, 39(2): 33-40孙路静, 孟 颖, 赵子旺, 等. 氧气促进纳米零价铁除砷效果及其作用机制[J
环境工程学报, 2021,15(1): 84-94.SUN Lu-jing, MENG Ying, ZHAO Zi-wang, et al. Effect and mechanism of oxygen promoted nano zero-valent iron for arsenic removal[J
Chinese Journal of Environmental Engineering, 2021, 15(1): 84-94.KONG Ming, LIU Qing-cai, WANG Xiao-qing, et al. Performance impact and poisoning mechanism of arsenic over commercial V2O5-WO3/TiO2 SCR catalyst[J
Catalysis Communications, 2015,72: 121-126.CHENG Dong, YUAN Song-hu, LIAO Peng, et al. Oxidizing impact induced by mackinawite (FeS) nanoparticles at oxic conditions due to production of hydroxyl radicals[J
Environmental Science & Technology, 2016, 50(21): 11646-11653.JANG J H, DEMPSEY B A. Coadsorption of arsenic(Ⅲ) and arsenic(Ⅴ) onto hydrous ferric oxide: effects on abiotic oxidation of arsenic(Ⅲ), extraction efficiency, and model accuracy[J
Environmental Science & Technology, 2008, 42(8): 2893-2898.WEI Yuan-feng, WEI Shu-dan, LIU Cheng-bin, et al. Efficient removal of arsenic from groundwater using iron oxide nanoneedle array-decorated biochar fibers with high Fe utilization and fast adsorption kinetics[J
Water Research, 2019, 167: 115107.BUKHTIYAROVA G A, BUKHTIYAROV V I, SAKAEVA N S, et al. XPS study of the silica-supported Fe-containing catalysts for deep or partial H2S oxidation[J
Journal of Molecular Catalysis A: Chemical, 2000, 158(1): 251-255.BAI Peng-peng, ZHENG Shu-qi, CHEN Chang-feng, et al. Investigation of the iron-sulfide phase transformation in nanoscale[J
Crystal Growth & Design, 2014,14(9): 4295-4302.刘 卓, 张小梅, 肖才林, 等. 利用天然磁黄铁矿去除水中As(Ⅴ)的研究[J
环境科学学报, 2016, 36(10): 3701-3708.LIU Zhuo, ZHANG Xiao-mei, XIAO Cai-lin, et al. As(Ⅴ) removal from water with natural pyrrhotite[J
Acta Scientiae Circumstantiae, 2016, 36(10): 3701-3708.WU J, XUE S B, BRIDGES D, et al. Fe-based ceramic nanocomposite membranes fabricated via e-spinning and vacuum filtration for Cd2+ ions removal[J
Chemosphere, 2019, 230: 527-535.DAI Xuan, YAN Song, CUI Li-shuang, et al. Fe(Ⅲ) modified Bi2O4 nano-rods for boosting photocatalytic performance through interfacial charge transfer effect[J
Ceramics International, 2020.YANG Dong, WANG Lu, LI Zhao-tao, et al. Simultaneous adsorption of Cd(Ⅱ) and As(Ⅲ) by a novel biochar-supported nanoscale zero-valent iron in aqueous systems[J
Science of the Total Environment, 2020, 708: 134823.HANSSON E B, ODZIEMKOWSKI M S, GILLHAM R W. Formation of poorly crystalline iron monosulfides: Surface redox reactions on high purity iron, spectroelectrochemical studies[J
Corrosion Science, 2006, 48(11): 3767-3783.MüLLER K, CIMINELLI V S T, DANTAS M S S, et al. A comparative study of As(Ⅲ) and As(Ⅴ) in aqueous solutions and adsorbed on iron oxy-hydroxides by Raman spectroscopy[J
Water Research, 2010, 44(19): 5660-5672.JIA Yong-feng, XU Li-ying, FANG Zhen, et al. Observation of surface precipitation of arsenate on ferrihydrite[J
Environmental Science & Technology, 2006, 40(10): 3248-3253.成 东. 马基诺矿接触氧气氧化时羟自由基产生及其对三价砷的氧化作用[D
武汉: 中国地质大学, 2016: 24-36.CHENG Dong. Hydroxyl radical formation upon oxidation of Machinawite (FeS) by oxygen and associated oxidation of arsenic[D
Wuhan: China University of Geosciences, 2016: 24-36.邵金秋, 温其谦, 阎秀兰, 等. 天然含铁矿物对砷的吸附效果及机制[J
环境科学, 2019, 40(9): 4072-4080.SHAO Jin-qiu, WEN Qi-qian, YAN Xiu-lan, et al. Adsorption and mechanism of arsenic by natural iron-containing minerals[J
Environmental Science, 2019, 40(9): 4072-4080.SHEN Biao-biao, WANG Xue-mei, ZHANG Yan, et al. The optimum pH and Eh for simultaneously minimizing bioavailable cadmium and arsenic contents in soils under the organic fertilizer application[J
Science of the Total Environment, 2020, 711: 135229.刘小燕, 曾清如, 周细红, 等. 尿素施用对砷污染土壤pH值及砷活性的影响[J
土壤通报, 2008, 39(6): 1441-1444.LIU Xiao-yan, ZENG Qing-ru, ZHOU Xi-hong, et al. The short-term changes of soil pH and available As by fertilizing urea in contaminated soils[J].Chinese Journal of Soil Science, 2008, 39(6): 1441-1444.FAN Yu-rui, ZHENG Chun-li, LIU Hong-xia, et al. Effect of pH on the adsorption of arsenic(Ⅴ) and antimony(Ⅴ) by the black soil in three systems: Performance and mechanism[J
Ecotoxicology and Environmental Safety, 2020, 191: 110145.
声明:
“硫化亚铁对As(Ⅲ)的吸附机理及其对As污染土壤的修复” 该技术专利(论文)所有权利归属于技术(论文)所有人。仅供学习研究,如用于商业用途,请联系该技术所有人。
我是此专利(论文)的发明人(作者)

 495
编辑:中冶有色技术网
来源:付君浩,邓朝政,曾礼强,张志峰,韩海生
495
编辑:中冶有色技术网
来源:付君浩,邓朝政,曾礼强,张志峰,韩海生
















 举报 0
举报 0
 收藏 0
收藏 0
 反对 0
反对 0
 点赞 0
点赞 0

